esanum - Das Ärztenetzwerk für approbierte Ärzte
oder
Magenkrebs: Auch Bakterien können Auslöser sein
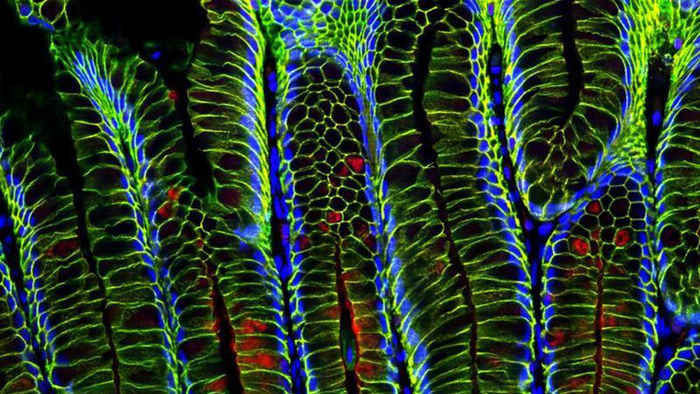
Helicobacterinfektion stimuliert Stammzellfunktion in gastrischen Drüsen
Wissenschaftler der Charité – Universitätsmedizin Berlin konnten in Kooperation mit Kollegen am Max-Planck-Institut für Infektionsbiologie, Berlin und der Stanford School of Medicine, Kalifornien zeigen, dass eine Helicobacterinfektion für die Entwicklung von Magenkrebs verantwortlich sein kann.
Die Studie stellt erstmals einen direkten Zusammenhang zwischen der Infektion und einer beschleunigten Stammzellenregeneration innerhalb der Magendrüsen her. Unter dem Einfluss des Bakteriums erhöht sich die Anzahl der Zellen mit Stammzellpotenzial und mit ihnen das Risiko einer pathologischen Veränderung, wie im aktuellen Fachmagazin Nature veröffentlicht ist.
Infektionen mit dem Magenbakterium Helicobacter pylori sind weit verbreitet. Gleichzeitig gelten sie als wichtigster Risikofaktor für das Entstehen von Magenkrebs. Nach einer Infektion kommt es zu einer vermehrten Zellteilung im infizierten Gewebe aufgrund eines bis dato unbekannten Mechanismus. Das Forscherteam um Michael Sigal, Medizinische Klinik mit Schwerpunkt Hepatologie und Gastroenterologie der Charité und BIH Charité Clinician Scientist, sowie Thomas F. Meyer, Direktor am Max-Planck-Institut für Infektionsbiologie, Berlin, konnte diesen Prozess nun erstmalig entschlüsseln. Die im Magen befindlichen Drüsen haben eine besonders hohe regenerative Kapazität. Alle ein bis zwei Wochen werden sie komplett ersetzt. Wie eine bakterielle Infektion unter diesen Umständen zu langfristigen Veränderungen führen kann, war bislang unklar.
"In der Basis der Drüsen finden sich jedoch langlebige Stammzellen, die stetig neue Zellen generieren", erklärt Sigal. "Wir wollten sowohl ihre Identität bestimmen, wie auch die Prozesse, die ihre Regeneration steuern", so der Studienleiter weiter. Die Charakterisierung der Stammzellen hat gezeigt, dass es zwei unterschiedliche Stammzellarten im Magen gibt. Beide sind positiv für den Marker Axin2. "Wir haben herausgefunden, dass die Zellen, die sich direkt unterhalb der Drüsen befinden, ein spezifisches Molekül namens R-spondin 3 produzieren. Dieses beeinflusst die Funktion der Stammzellen maßgeblich. Es aktiviert die Zellteilung in einer Teilpopulation der Stammzellen und steigert dadurch die Regerationsgeschwindigkeit der gastrischen Drüsen", so der Wissenschaftler. Eine Infektion mit Helicobacter pylori führt dazu, dass die Produktion von R-spondin ansteigt und die Stammzellaktivität zunimmt. Es ist zu vermuten, dass eine langfristig erhöhte Stammzellenteilung die Krebsentstehung direkt begünstigt.
Bakterielle Infektionen nicht nur an der Zelloberfläche
Im Rahmen der Studie haben die Forscher unter anderem die Stammzellen des Magens im Tiermodell charakterisiert. Mittels sensitiver neuer Techniken konnten Moleküle im Magengewebe in hoher Auflösung dargestellt werden. So ist es gelungen, Moleküle, die die Stammzellen regulieren, abzubilden und ihre räumliche Nähe zum Stammzellbereich zu zeigen. Ebenfalls zum Einsatz kamen ein Modell der Infektion mit Helicobacter pylori, das die ersten Vorstufen der Krebsentwicklung im Menschen nachempfindet sowie Experimente mittels sogenannter Organoide. Hierbei handelt es sich um Zellkulturen, die aus menschlichen und tierischen Stammzellen direkt aus dem Magengewebe gewonnen wurden.
Während lange bekannt ist, dass bestimmte Viren Krebs auslösen können, indem sie Gene in die Wirtszelle einschleusen, werden auch Bakterien als Auslöser von Krebserkrankungen untersucht, wobei die zugrundeliegenden Mechanismen weniger klar sind. Jetzt konnten die Teams um Sigal und Meyer in Zusammenarbeit mit weiteren Kooperationspartnern das bislang geltende Dogma überwinden, bakterielle Infektionen würden lediglich Zellen an der Oberfläche beeinflussen. "Helicobacter pylori verursacht eine lebenslange Infektion und steigert die Anzahl der langlebigen Zellen mit Stammzellpotenzial in den Drüsen des Magens. Die Geschwindigkeit der Stammzellteilung ist erhöht, was letztlich in pathologischen Veränderungen des Epithels resultiert", folgert Michael Sigal.
"Die Studie gibt uns einen besseren Einblick in die Mechanismen, die Magenkrebs auslösen können. Sie gibt uns auch allgemeinere Hinweise darauf, wie chronische bakterielle Infektionen die Gewebefunktion stören und so das Krebsrisiko erhöhen können", fügt Thomas F. Meyer hinzu. Mit seinen Kollegen beschäftigt er sich seit vielen Jahren mit den krankmachenden Eigenschaften des Bakteriums Helicobacter pylori und seinem Einfluss auf die Magenoberfläche, dem Epithel. Auf lange Sicht können die aktuellen Erkenntnisse dazu beitragen, die Entwicklung verbesserter Behandlungsansätze voranzubringen.

Kommentare
In einigen Veröffentlichungen wurde H. pylori als definitives Karzinogen bezeichnet dessen Eradikation eine Senkung der Magenkrebsrate um den Faktor 2 bis 3 bewirken könnte. Unter allen Karzinomen steht das Magenkarzinom an zweiter Stelle als Krebstodesursache auch wenn es in den letzten 50 jahren in den Industrieländern deutlich abgenommen hat. Für uns ist die Klinik der B-Gastritis die häufigste chronische bakterielle Erkrankung.
Folgt natürlcih auch die frage welche Tumore werden dadurch besonders begünstigt? Im groben gibt es folgende: die Adenokarzinomen des Magens sind pathologisch-anatomisch zwei Typen zu unterscheiden- der weitaus häufigere intestinale, bevorzugt im distalen Magen auftretende Typ und der diffuse Typ, der sich in allen Magenbereichen, hauptsächlich jedoch im Bereich der Kardia entwickelt. Für das distale Magenkarzinom ist gut belegt, daß es sich in der Regel auf dem Boden einer chronisch-atrophischen Gastritis ausbildet, die mit einer intestinalen Metaplasie und dysplastischen Schleimhautveränderung einhergeht. Als weitere, jedoch relativ seltene Vorerkrankungen des Magenkarzinoms werden die perniziöse Anämie, die hypertrophische Gastropathie (Morbus Ménétrier wir erinnern uns an die Diagnostik des Schwindels) und adenomatöse Schleimhautpolypen angesehen. Laut dieser neuen Erkenntnisse sind eigentlich alle.
Für mich klinisch relevant ist als Konsequenz - wen sollen wir screenen und auf welchen Annahmen beruht die H. pylori These (denn diese beiden Punkte korrelieren)?
Hier gibt es eine Liste epidemiologischen und sozioökonomischen Beobachtungen die mir zum einen zusätzlich das Verständnis für die Schlussfolgerungen der Studie erleichterten und die Screeningfrage beantworten:
1.die Magenkrebsrate korreliert in mehreren Ländern mit dem serologisch erwiesenen Befall der Bevölkerung durch H. pylori
2.bei 40 bis 80 Prozent der Patienten mit Magenkarzinom ist histologisch oder serologisch eine Infektion mit H. pylori festzustellen
3. das Risiko eines Magencas nach H.pyloriinfektion ist relativ erhöht um 2,8-6
4. H. pylori entwickelt sich schnell während der Kindheit und ist in manchen afrikanischen und asiatischen Ländern bei 80 bis 90 Prozent der Erwachsenen nachzuweisen -> vor allem im Zuge der aktuellen Flüchtlingskrise ein hochrelevantes Thema!
5. betroffen sind vor allem die unteren und untersten sozialen Schichten - und Personen mit einer lokalen Häufung.
Das Bakterium Helicobacter pylori löst die sogenannte B-Gastritits aus (B für Bakterium). Diagnostisch wegweisend ist die Magenspiegelung mit der Entnahme von Biopsien sowie ggf. ein Helicobacter pylori-Nachweis. Darüber hinaus können Blutbildveränderungen auftreten (z.B. makrozytäre Anämie bei Typ-A-Gastritis oder mikrozytäre Anämie bei chronischen Blutungen). Therapeutisch steht je nach Ätiologie eine antibiotische Therapie (Eradikationstherapie bei HP-Nachweis), die Hemmung der Säureproduktion (bei Typ-B- und Typ-C-Gastritis) bzw. die Substitution von Vitamin B12 (bei Typ-A-Gastritis) im Vordergrund. Unbehandelt kann es zu Komplikationen wie Ulkus und Perforation kommen, darüber hinaus besteht ein erhöhtes Risiko zur Entstehung von Magenkarzinomen und MALT-Lymphomen. So wird es momentan an der Uni gelehrt. Was könnte spannender sein, als dem Entstehungsmechanismus des Magenkarzinoms auf den Grund zu gehen? Mit der Identifikation des Moleküls R-spondin sind die Kollegen mit ihrem Vorhaben bereits beachtlich weit gediehen. Die Diagnosesicherung des Magenkarzinoms erfolgt über direkte Biopsieentnahme im Rahmen der Gastroskopie, Tumormarker hingegen sind vor allem zur Verlaufskontrolle geeignet. Therapeutisch ist die operative Resektion (partielle oder totale Gastrektomie) das einzige kurative Verfahren. Eine neoadjuvante Therapie kann im fortgeschrittenen Stadium – solange keine Fernmetastasen bestehen – helfen, den Tumor auf eine resezierbare Größe zu verkleinern und damit einen kurativen Ansatz verfolgen. Auch adjuvante Chemotherapien erhöhen die Überlebenswahrscheinlichkeit bei Patienten im fortgeschrittenen Tumorstadium. Palliativ kommen Chemotherapien und die medikamentöse Behandlung mit Trastuzumab infrage, während zur Erhaltung der Passage chirurgische (Gastroenterostomie) sowie endoskopische (Stenteinlagen) Verfahren möglich sind. Die Prognose sieht relativ düster aus: Da das Magenkarzinom häufig keine Frühsymptome aufweist, erfolgt die Diagnosestellung in 60% der Fälle erst in einem fortgeschritteneren Stadium, in dem eine kurative Therapie nicht mehr möglich ist. Hoffen wir auf neue therapeutische Ansätze, die an die Forschungsergebnisse der Kollegen der Charité anknüpfen.